再生医療等製品の製造において、製品品質の恒常的な安定化は極めて重要な課題です。特に細胞という「生き物」を扱う現場では、従来の3ロット検証だけでは捉えきれないプロセス変動に直面し、頭を悩ませている製造技術担当者や品質保証責任者の方も多いのではないでしょうか。
本記事では、規制当局も推奨する科学的な管理手法である「継続的プロセスベリフィケーション(CPV)」の導入について、その定義から実践的なステップ、再生医療特有の課題への対処法までを詳しく解説します。商用生産への移行期にある方や、より堅牢な品質保証体制を構築したいと考えている方にとって、現場で役立つ具体的な指針となれば幸いです。
再生医療における継続的プロセスベリフィケーション(CPV)の導入とは
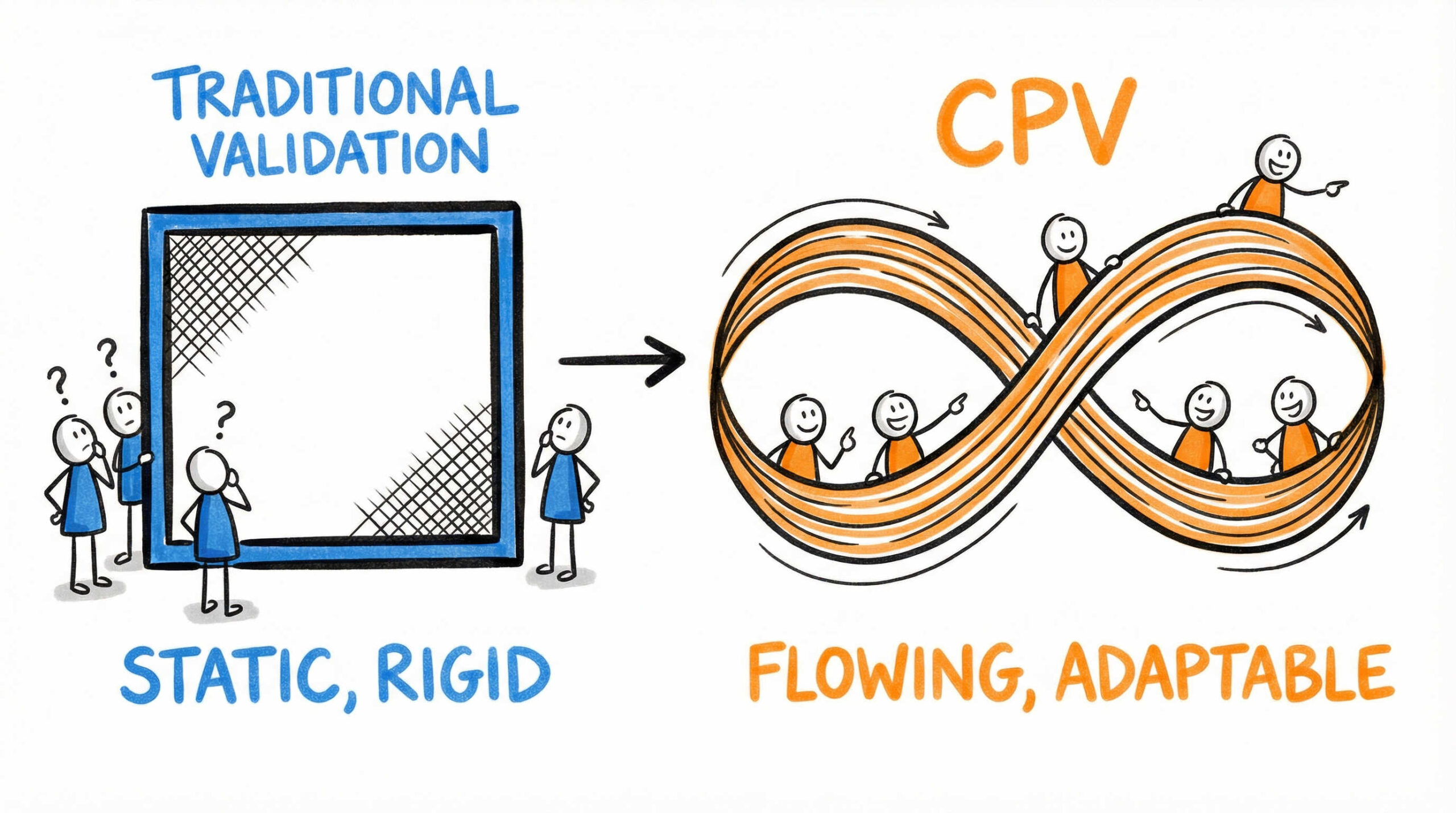
再生医療の現場において、品質管理のアプローチは大きな転換点を迎えています。ここでは、従来の固定的なバリデーション手法と、最新の継続的プロセスベリフィケーション(CPV)がどのように異なるのか、その本質的な定義と目的について解説します。まずはCPVの基本概念を正しく理解することから始めましょう。
従来のプロセスバリデーション(3ロット検証)とCPVの決定的な違い
従来のプロセスバリデーションは、主に「3ロットの実製造」によってプロセスの妥当性を確認する手法が一般的でした。しかし、この「ゴールデンバッチ」と呼ばれる限られたデータだけでは、長期間にわたる製造過程で生じうる原材料のばらつきや、経時的な変動を十分に検知することは困難です。
これに対し、継続的プロセスベリフィケーション(CPV)は、商用生産移行後も継続的にデータを収集・監視し、プロセスが管理状態にあることを常に保証し続ける手法です。
- 従来: 「検証完了」という静的なゴールがある
- CPV: 製品ライフサイクル全体を通じた動的な管理
このように、CPVの導入は「点」での確認から「線」での監視へと、品質保証の概念を根本から変えるものといえるでしょう。
ライフサイクルマネジメントにおけるステージ3(CPV)の定義と位置づけ
医薬品の品質ガイドラインにおいて、プロセスバリデーションは製品のライフサイクル全体を通じて実施されるべきものと定義されています。このライフサイクルは大きく3つのステージに分類されます。
- ステージ1(プロセス設計): 開発段階での知識蓄積
- ステージ2(プロセス適格性確認): いわゆるPPQ(Process Performance Qualification)
- ステージ3(継続的プロセスベリフィケーション): 商用生産中の継続的な確認
CPVはこの「ステージ3」に位置づけられます。開発段階や適格性確認で得られた管理戦略が、実際の商用生産においても有効に機能し続けているかを確認し、必要に応じて改善を行うための重要なフェーズなのです。
細胞由来製品の品質安定化に向けた科学的管理手法への転換
再生医療等製品、特に細胞加工製品においては、ドナー由来の原材料の不均一性が避けられません。そのため、製造プロセスを固定化するだけでは、最終製品の品質を一定に保つことが難しい場合があります。
CPVの導入は、経験や勘に頼るのではなく、データに基づいた科学的な管理手法への転換を意味します。収集したデータを統計的に解析し、プロセスの挙動を客観的に把握することで、「なぜ品質が変動したのか」を科学的に説明できるようになります。このアプローチにより、予期せぬ逸脱を未然に防ぎ、製品品質の信頼性を高めることが可能になるのです。
再生医療等製品でCPV導入が不可欠となる理由と規制動向
なぜ今、再生医療等製品においてCPVの導入が強く求められているのでしょうか。それは単なるトレンドではなく、国際的な規制要件への対応と、細胞製品特有のリスク管理という実質的な必要性に基づいています。ここでは、その背景にある規制動向と導入のメリットについて掘り下げていきます。
ICH Q8・Q10・Q12ガイドラインに基づく医薬品品質システムの要件
医薬品規制調和国際会議(ICH)のガイドライン、特にQ8(製剤開発)、Q10(医薬品品質システム)、Q12(医薬品のライフサイクルマネジメント)では、製品品質を継続的に改善・保証する仕組みが求められています。
これらは、開発段階から製造終了まで一貫した品質管理を目指すものであり、CPVはその中核を担う活動の一つです。医薬品品質システム(PQS)の中でCPVを運用することは、単にデータを集めるだけでなく、そのデータを経営層への報告やプロセスの改善(CAPA)につなげ、組織全体で品質文化を醸成するために不可欠な要件となっています。
GCTP省令および規制当局が求める「恒常的な品質保証」への対応
日本のGCTP(再生医療等製品の製造管理及び品質管理の基準)省令においても、製品の品質を恒常的に保証することが求められています。特に、承認申請時や定期的な査察において、規制当局は「プロセスが管理状態にあること」を示す客観的な証拠を重視する傾向にあります。
CPVを導入し、継続的なモニタリングデータを提示できれば、製造プロセスが安定していることを科学的に証明できます。これは、規制当局からの指摘事項を減らすだけでなく、変更管理や承認事項の一部変更申請(一変)をスムーズに進めるための強力な根拠資料としても機能するでしょう。
原材料(細胞)のばらつきを許容・管理するためのQbDアプローチ
再生医療等製品の最大の特徴は、原材料である細胞の個体差やロット間差が大きいことです。この「ばらつき」を前提としつつ、最終製品の品質を規格内に収めるためには、QbD(Quality by Design:品質設計)のアプローチが欠かせません。
CPVの導入により、原材料の特性(CMA)とプロセスパラメータ(CPP)、そして品質特性(CQA)の相関関係を継続的に検証できます。これにより、「どの程度の原材料のばらつきならプロセスで吸収できるか」というデザインスペースの理解が深まり、柔軟かつ堅牢な製造管理が可能になります。
商用生産移行後のプロセス変動検知と逸脱リスクの低減
商用生産に移行した後、予期せぬプロセスの変動(ドリフトやシフト)が発生することは珍しくありません。CPVによる常時モニタリングを行っていれば、これらの変動を早期に検知することが可能です。
例えば、規格内であっても統計的に異常な傾向(OOT:Out of Trend)が見られた場合、逸脱(OOS:Out of Specification)に至る前に対策を講じることができます。これは、高価で貴重な細胞製品の廃棄ロスを減らし、安定供給を実現するために極めて高い経済的価値をもたらします。リスクベースのアプローチで監視を強化することで、品質トラブルを未然に防ぐことができるのです。
CPV導入の実践的ステップ:準備から運用開始まで
CPVの重要性は理解できても、実際にどのように導入を進めればよいのか悩まれる方も多いでしょう。ここでは、計画の策定から実際のモニタリング運用まで、5つの実践的なステップに分けて解説します。順を追って進めることで、確実な体制構築を目指しましょう。
ステップ1:CPV計画書の策定とリスクアセスメントの実施
最初のステップは、CPVを実施するための全体計画(プロトコル)の策定です。どの製品、どの工程を対象とするのか、どのようなスケジュールで実施するのかを明確にします。
この際、重要になるのがリスクアセスメントです。すべてのパラメータを監視することは現実的ではないため、製品品質への影響度に基づいてリスクを評価し、モニタリングの優先順位を決定します。
- 品質リスクの高い工程を特定する
- 過去の逸脱データや開発段階の知見を活用する
このように、メリハリのある計画を立てることが、効率的な運用の第一歩です。
ステップ2:重要品質特性(CQA)と重要工程パラメータ(CPP)の再特定
次に、監視対象となる項目を具体的に定めます。ここでは、重要品質特性(CQA)と重要工程パラメータ(CPP)の再特定を行います。開発段階で設定されたCQA/CPPが、商用生産の実態に即しているかを見直す良い機会でもあります。
- CQA (Critical Quality Attributes): 純度、力価、安全性など製品の品質に関わる特性
- CPP (Critical Process Parameters): 温度、培養時間、試薬濃度など品質に影響を与える工程条件
これらを明確に紐づけ、どのパラメータが変動するとどの品質特性に影響するかを整理しておくことが重要です。
ステップ3:プロセス分析技術(PAT)を用いたリアルタイムデータ収集
データを効率的かつ正確に収集するためには、プロセス分析技術(PAT)の活用が有効です。PATとは、原材料や工程中の物質の物理的・化学的属性をリアルタイムで測定・分析するシステムやツールを指します。
例えば、培養中のグルコース濃度やpH、生細胞密度などをインラインセンサーで連続的にモニタリングすることで、サンプリングによるタイムラグなしにプロセスの状態を把握できます。手書き記録から自動データ収集へ移行することで、データの信頼性も向上するでしょう。
ステップ4:適切な統計的手法の選定と管理限界値の設定
収集したデータを評価するためには、適切な統計的手法を選定し、管理限界値を設定する必要があります。ここで重要なのは、製品の「規格値(仕様)」と、プロセスの「管理限界値」を混同しないことです。
管理限界値は、プロセスが統計的に安定している状態(管理状態)の範囲を示します。過去の製造データ(ヒストリカルデータ)に基づき、3シグマ法などを用いて上限・下限を設定します。初期段階ではデータ数が少ないため、暫定的な限界値を設定し、データ蓄積に伴って見直していくアプローチが一般的です。
ステップ5:モニタリング運用の開始と定期的レビュー体制の構築
準備が整ったら、いよいよモニタリング運用の開始です。製造ロットごとにデータを入力・プロットし、管理図を用いてトレンドを確認します。しかし、運用して終わりではありません。
定期的なレビュー体制の構築がCPVの肝となります。
- 月次または四半期ごとのトレンド評価
- 年次品質レビュー(PQR)での包括的な分析
これらを定例化し、品質部門と製造部門が連携してデータを議論する場を設けることで、継続的な改善サイクルを回していくことが大切です。
CPV運用に必要な統計解析手法とデータ管理システム
CPVを効果的に運用するためには、統計学の基礎知識と、データを適切に管理するシステムの支えが必要です。ここでは、現場で頻繁に使用される統計解析手法の基本と、データの信頼性を守るためのシステム要件について解説します。専門的な内容をわかりやすく紐解いていきましょう。
管理図(シューハート管理図等)によるトレンド分析と異常検知
CPVにおいて最も基本的かつ強力なツールが「管理図」です。中でもシューハート管理図(Xbar-R管理図など)は、プロセスの変動が「偶然原因」によるものか、何らかのトラブルによる「異常原因」によるものかを判別するのに役立ちます。
管理図上にデータをプロットし、管理限界線(UCL/LCL)を超えた場合や、中心線に対して一方に偏るなどの特定のパターン(連や傾向)が見られた場合は、統計的な異常とみなします。これにより、規格内であっても「何かがおかしい」という兆候を早期に捉えることができるのです。
工程能力指数(Cpk/Ppk)を用いたプロセス能力の評価方法
プロセスが規格を満たす能力を数値化したものが「工程能力指数」です。CPVでは、主にCpk(工程能力指数)やPpk(工程性能指数)を用いて評価します。
- Cpk: 短期的な工程能力を示し、理想的な状態での実力を表す
- Ppk: 長期的な工程性能を示し、実際の製造のばらつきを含んだ実力を表す
一般的に、これらの値が1.33以上であれば工程は十分な能力があると判断されます。再生医療製品ではばらつきが大きくなりがちですが、これらの指標を継続的に監視することで、工程の安定性向上の目安とすることができます。
許容範囲(Tolerance)と管理限界(Control Limit)の明確な区別
CPVを実践する上で、多くの担当者が混同しやすいのが「許容範囲(規格値)」と「管理限界」の違いです。この区別は非常に重要です。
- 許容範囲(Tolerance/Specification): 製品が出荷できるか否かを判定するライン(顧客や規制の要求)
- 管理限界(Control Limit): プロセスが安定しているか否かを判断するライン(プロセスの実力値)
管理限界は通常、許容範囲よりも内側に設定されます。管理限界を逸脱しても、許容範囲内であれば製品は合格ですが、プロセスは不安定であるため調査が必要です。この概念を正しく理解することが、CPV成功の鍵です。
データインテグリティ(DI)を確保したデータ収集・解析基盤の整備
統計解析の前提となるのは「正しいデータ」です。データの生成から廃棄まで、完全性、一貫性、正確性を保証するデータインテグリティ(DI)の確保は必須要件です。
手書き記録やExcel管理では、入力ミスや改ざんのリスクを完全に排除することは困難です。そのため、製造実行システム(MES)や実験室情報管理システム(LIMS)、あるいは専用の統計解析ソフトウェアを導入し、監査証跡(オーディットトレイル)が残る環境でデータを収集・解析する基盤整備が進められています。信頼できるデータがあってこそ、正しい判断が可能になります。
再生医療現場におけるCPV導入特有の課題と解決策

再生医療製品の製造には、一般的な医薬品とは異なる特有の難しさがあります。CPVを導入する際にも、これらの特性が壁となることが少なくありません。ここでは、再生医療現場ならではの課題に焦点を当て、それらを乗り越えるための現実的な解決策を提示します。
製造ロット数(N数)が少ない初期段階での統計的アプローチ
再生医療製品は少量生産が多く、統計解析に必要なデータ数(N数)を確保するのに時間がかかります。「N数が少ないのに管理図が引けるのか」という疑問はもっともです。
解決策としては、初期段階では開発データや類似製品のデータを参考にして暫定的な管理限界を設定する方法があります。また、ベイズ統計のような少サンプルに適した手法の検討や、ロットごとのデータだけでなく、培養中の経時データ(時系列データ)を活用して情報量を増やすアプローチも有効です。データが蓄積されるにつれて、段階的に管理基準を見直していく柔軟な運用が求められます。
手技に依存するマニュアル工程における変動要因の抽出と管理
細胞培養などの工程は、熟練者の手技に依存する部分が依然として多く残っています。人による操作は、微妙な撹拌速度の違いやピペッティングの差など、変動要因となりがちです。
これらを管理するためには、作業手順書(SOP)の細分化や動画マニュアルによる教育徹底に加え、可能な範囲での自動化機器の導入が効果的です。また、CPVのデータ分析において「作業者」を層別因子として解析することで、手技によるばらつきを特定し、トレーニングの重点項目を明確にすることも可能です。
ドナー差に起因する原材料のばらつきと管理幅の整合性確保
他家(同種)由来、自家(自己)由来を問わず、ドナーによる細胞の性質の違いは避けられません。原材料のばらつきが大きすぎると、管理限界の幅が広くなりすぎて異常検知が遅れるリスクがあります。
対策としては、原材料の受入試験項目を強化し、製造に使用する細胞の品質を一定レベルに揃えることが第一です。その上で、ドナー属性(年齢、性別など)ごとにデータを層別して管理図を作成したり、原材料の特性に応じてプロセスパラメータを調整するフィードバック制御を取り入れたりすることで、最終製品の品質を一定範囲に収める工夫が必要です。
既存の品質保証システム(PQS)とCPVプロセスの統合
CPVを導入しても、既存の品質保証システム(PQS)と乖離していては形骸化してしまいます。逸脱管理や変更管理のプロセスと、CPVのモニタリング結果が連動していないケースが散見されます。
CPVで検知されたOOT(傾向異常)を、既存の是正予防措置(CAPA)システムにどのように組み込むか、手順を明確にする必要があります。定期的な品質レビュー(PQR)のインプットとしてCPVデータを正式に位置づけ、品質部門だけでなく製造部門、開発部門も交えたクロスファンクショナルなチームでデータを共有・活用する仕組み作りが、統合への近道です。
まとめ
本記事では、再生医療における継続的プロセスベリフィケーション(CPV)の導入について解説してきました。
CPVは、従来の「3ロット検証」という点での確認から、製品ライフサイクル全体を見渡す「線」での科学的管理への進化を意味します。規制要件への対応はもちろんですが、細胞という変動しやすい原材料を扱う再生医療においてこそ、その真価が発揮される手法です。
導入には統計的手法の理解やデータ収集体制の整備など、乗り越えるべきハードルはありますが、それによって得られる「恒常的な品質保証」と「リスク低減」という果実は、製品の信頼性を大きく高めるものとなるでしょう。まずはできるところから、小さな一歩を踏み出してみてはいかがでしょうか。
継続的プロセスベリフィケーション(CPV)の導入についてよくある質問

CPVの導入に関して、現場の担当者からよく寄せられる質問をまとめました。導入検討時の参考にしてください。
- Q1. 既存の製品(すでに承認済みの製品)にもCPVを導入する必要がありますか?
- はい、推奨されます。ライフサイクルマネジメントの観点から、既存製品であっても商用生産中のデータを継続的に評価し、品質の安定性を確認することは規制当局からも期待されています。
- Q2. 統計解析ソフトは必ず導入しなければなりませんか?
- 必須ではありませんが、強く推奨されます。Excelでも管理図は作成可能ですが、データインテグリティ(DI)の確保や複雑な統計解析、大量データの処理を考慮すると、バリデーションされた専用ソフトの導入が効率的かつ確実です。
- Q3. 管理限界を外れた場合(OOT)、直ちに製品は不適合(OOS)になりますか?
- いいえ、なりません。管理限界外(OOT)は「プロセスが不安定な状態」を示しますが、製品規格(許容範囲)内であれば製品自体は適合品です。ただし、原因究明と是正措置を行う必要があります。
- Q4. 小規模な製造現場でコストをかけずに始める方法はありますか?
- まずは重要工程パラメータ(CPP)と重要品質特性(CQA)を絞り込み、Excel等を用いて主要な項目のトレンドグラフを作成することから始めてみてください。スモールスタートでデータを可視化するだけでも大きな一歩です。
- Q5. CPVの実施頻度はどのくらいが適切ですか?
- 製品のリスクや製造頻度によりますが、製造ロットごとにデータを入力・確認するのが基本です。その上で、月次や四半期ごとなど、定期的にまとめて傾向分析を行うレビューの場を設けるのが一般的です。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "既存の製品(すでに承認済みの製品)にもCPVを導入する必要がありますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "はい、推奨されます。ライフサイクルマネジメントの観点から、既存製品であっても商用生産中のデータを継続的に評価し、品質の安定性を確認することは規制当局からも期待されています。"
}
},
{
"@type": "Question",
"name": "統計解析ソフトは必ず導入しなければなりませんか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "必須ではありませんが、強く推奨されます。Excelでも管理図は作成可能ですが、データインテグリティ(DI)の確保や複雑な統計解析、大量データの処理を考慮すると、バリデーションされた専用ソフトの導入が効率的かつ確実です。"
}
},
{
"@type": "Question",
"name": "管理限界を外れた場合(OOT)、直ちに製品は不適合(OOS)になりますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "いいえ、なりません。管理限界外(OOT)は「プロセスが不安定な状態」を示しますが、製品規格(許容範囲)内であれば製品自体は適合品です。ただし、原因究明と是正措置を行う必要があります。"
}
},
{
"@type": "Question",
"name": "小規模な製造現場でコストをかけずに始める方法はありますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "まずは重要工程パラメータ(CPP)と重要品質特性(CQA)を絞り込み、Excel等を用いて主要な項目のトレンドグラフを作成することから始めてみてください。スモールスタートでデータを可視化するだけでも大きな一歩です。"
}
},
{
"@type": "Question",
"name": "CPVの実施頻度はどのくらいが適切ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "製品のリスクや製造頻度によりますが、製造ロットごとにデータを入力・確認するのが基本です。その上で、月次や四半期ごとなど、定期的にまとめて傾向分析を行うレビューの場を設けるのが一般的です。"
}
}
]
}
</script>