再生医療等製品の開発から商用生産への移行期において、多くの製造管理者や品質保証(QA)担当者が直面するのが、GCTP省令に適合したプロセスバリデーション(PV)計画書の策定です。細胞加工製品特有の原材料のばらつきや製造工程の複雑さは、一般的な医薬品と比較しても計画策定の難易度を格段に高めています。しかし、規制当局の査察に耐えうる科学的妥当性を持った計画書を作成することは、製品の品質と安全性を担保する上で避けては通れません。
本記事では、再生医療業界のプロフェッショナルに向けて、プロセスバリデーション計画の策定手法を具体的かつ実践的に解説します。必須項目の詳細から、リスクマネジメントに基づいた手順、そして再生医療特有の課題への対処法まで、実務に即した知見を網羅しました。確実な品質保証体制の構築にお役立てください。
再生医療におけるプロセスバリデーション計画策定の重要性と結論
再生医療等製品におけるプロセスバリデーション計画の策定は、単なる文書作成作業ではなく、製品の品質を一貫して保証するための基盤づくりです。GCTP省令(再生医療等製品の製造管理及び品質管理の基準に関する省令)への適合は法的要件であり、計画書はその遵守状況を示す最も重要な証拠となります。ここでは、なぜ綿密な計画策定が不可欠なのか、その本質的な意義について解説します。
GCTP省令適合に向けたプロセスバリデーション(PV)の定義
GCTP省令において、プロセスバリデーション(PV)は「ある製造工程が、予め設定された判定基準に適合する製品を恒常的に製造できることを検証し、文書化すること」と定義されます。再生医療等製品においては、特に「恒常的に」という点が重要課題となります。生きた細胞を扱うため、原材料の不均一性が避けられない中で、いかにして最終製品の品質(CQA)を一定の範囲内に収めるか。PV計画書は、この難題に対して製造所がどのようにアプローチし、制御しようとしているかを示す設計図といえるでしょう。単なる試験結果の羅列ではなく、プロセス全体の管理能力を実証することが求められます。
科学的妥当性に基づいた計画書が品質保証の鍵となる理由
品質保証の現場において、計画書の価値を左右するのは「科学的妥当性(Scientific Justification)」の有無です。なぜそのパラメータを重要工程パラメータ(CPP)として選定したのか、なぜその管理幅(レンジ)を設定したのか。これらが経験則や勘ではなく、開発段階からのデータや科学的知見に基づいて論理的に説明されている必要があります。科学的根拠に基づいた計画書は、予期せぬ逸脱が発生した際の原因究明を容易にし、CAPA(是正措置・予防措置)の実効性を高めることにも繋がります。つまり、計画策定のプロセスそのものが、製品への理解を深める機会となるのです。
査察対応を見据えた論理構成と文書化の必要性
規制当局による査察や適合性調査において、プロセスバリデーション計画書は必ず精査される文書の一つです。ここで重視されるのは、結論に至るまでの論理構成と、それが第三者に伝わる形で文書化されているかという点です。「実施したこと」だけでなく「実施するに至った理由」と「判定基準の妥当性」が明記されていなければ、査察官の納得を得ることは難しいでしょう。計画段階から報告書の構成を見据え、データのトレーサビリティを確保し、誰が読んでも同じ解釈ができる明瞭な記述を心がけることが、スムーズな承認取得への近道となります。
プロセスバリデーション計画書に記載すべき必須項目

プロセスバリデーション計画書に記載すべき項目に漏れがあると、バリデーション自体の有効性が問われる事態になりかねません。GCTP省令や関連ガイドラインを参照しつつ、実務上必要不可欠な項目を網羅的に盛り込む必要があります。ここでは、計画書に必ず含めるべき9つの主要項目について、その記載ポイントを整理します。これらをチェックリストとして活用することで、不備のない計画書作成を目指しましょう。
バリデーションの目的および適用範囲の明確化
まず冒頭で、そのバリデーションが何を対象とし、何を目的に実施されるのかを明確に定義します。対象となる製品名、工程(全工程か一部の工程か)、製造場所、適用される規制などを具体的に記述します。目的については、「商用生産に向けたプロセスの妥当性確認」や「製造方法変更に伴う再バリデーション」など、実施の背景を含めて記載することで、文書の位置づけが明確になります。範囲外となる事項についても明記しておくと、後の誤解を防ぐことができるでしょう。
実施組織の体制・責任者および教育訓練状況
バリデーションを遂行するための組織体制を記載します。バリデーション責任者、実施担当者、品質保証部門の責任者など、各役割と責任の所在を明確にします。特に重要なのは、実施に関わる人員が適切な教育訓練を受けていることを示す記述です。再生医療等製品の製造には高度な無菌操作手技などが求められるため、特定の手技認定を受けた作業者が担当することや、その教育訓練記録への参照を盛り込むことが推奨されます。
製造プロセスの概要とフローチャート
対象となる製造プロセスの全体像を、フローチャートを用いて視覚的に分かりやすく記述します。原材料の受け入れから、培養、加工、充填、包装、出荷判定に至るまでの流れを示し、各ステップにおける管理ポイント(In-Process Control: IPC)を明記します。文章だけの説明では工程の複雑さが伝わりにくい場合でも、図解することで工程間の関係性や重要工程の位置づけが直感的に理解できるようになります。
重要工程パラメータ(CPP)と管理幅の設定
製品品質に影響を与える重要工程パラメータ(CPP)を特定し、その管理幅(許容範囲)を設定します。例えば、培養温度、CO2濃度、培養時間、試薬の添加量などが該当します。設定値(Set Point)だけでなく、許容される変動幅(Range)を記載し、その範囲内であれば品質に影響がないという根拠(開発データやリスク評価結果)を引用することが重要です。この設定がバリデーションの成否を握る核心部分となります。
重要品質特性(CQA)と規格値の関連付け
重要品質特性(CQA)とは、製品の安全性、有効性、同一性を保証するために制御すべき物理的、化学的、生物学的特性のことです。細胞数、生存率、純度、力価(ポテンシー)、無菌性などが挙げられます。各CPPがどのCQAに影響を与えるのかをマトリクスなどで関連付け、CQAごとに設定された規格値(判定基準)を明記します。これにより、プロセス管理と最終製品品質の因果関係が明確になります。
使用する製造設備・試験機器の適格性評価(IQ/OQ/PQ)状況
プロセスバリデーションを開始する前提条件として、使用する製造設備や試験機器の適格性評価(IQ/OQ/PQ)が完了していることが必須です。計画書には、主要な設備・機器のリストとともに、適格性評価が完了していること、あるいはPV実施までに完了予定であることを宣言します。校正(キャリブレーション)や日常点検の状況についても触れ、設備が意図した通りに機能する状態でバリデーションが行われることを保証します。
サンプリング計画と試験検査方法の妥当性
バリデーション中のサンプリングは、日常生産時よりも頻度や検体数を増やして行うのが一般的です。どの工程で、どのタイミングで、どれだけの量を採取するのか、具体的な計画を記載します。また、採用する試験検査方法がバリデートされていること(分析法バリデーションの完了)も確認が必要です。サンプリング方法自体が製品品質に悪影響を与えないことや、検体の代表性が確保されていることへの言及も忘れてはなりません。
バリデーションの判定基準と成功の定義
バリデーションが「成功」したと判断するための基準を事前に定めます。全てのCQAが規格内に収まることはもちろん、CPPが管理幅内で推移したこと、逸脱がなく(あるいは許容範囲内で)完了したことなど、具体的な条件を列挙します。判定基準は曖昧さを排除し、数値や明確な状態(Pass/Fail)で記述する必要があります。この基準をクリアすることで、初めてプロセスの妥当性が証明されます。
逸脱発生時の対応手順と変更管理の方針
バリデーション実施中に予期せぬ逸脱が発生した場合の対応フローを定めます。逸脱発生時の報告ルート、影響評価の方法、バリデーション継続の可否判断などをあらかじめ決めておくことで、迅速な対応が可能になります。また、計画書承認後に内容を変更する必要が生じた場合の変更管理手順についても記載し、勝手な変更が行われないよう歯止めをかけます。これらは品質システムの堅牢性を示す重要な要素です。
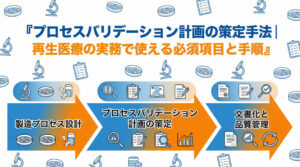
実践的なプロセスバリデーション計画の策定手順
必須項目を理解した上で、実際に計画書を作成する手順を見ていきましょう。効果的なプロセスバリデーション計画は、一朝一夕にできるものではなく、製品開発段階からの情報の積み上げによって構築されます。ここでは、Quality by Design (QbD) の考え方を取り入れた、実践的な策定フローを5つのステップで解説します。
手順1:製品開発データに基づくCQAとCPPの特定
計画策定の第一歩は、製品開発段階で得られた知識の整理です。基礎研究や非臨床試験の結果から、製品の安全性と有効性に関わる重要品質特性(CQA)を特定します。次に、製造プロセスのどのパラメータがCQAに影響を与えるかを分析し、重要工程パラメータ(CPP)を抽出します。この段階では、実験計画法(DoE)などの統計的手法を用いて、パラメータ間の相互作用やデザインスペースを把握しておくことが理想的です。開発データの質が、後の計画書の説得力を決定づけます。
手順2:品質リスクマネジメント(QRM)による評価項目の絞り込み
抽出された全てのパラメータをバリデーション対象とすると、膨大なリソースが必要となります。そこで、品質リスクマネジメント(QRM)の手法を用いて評価項目の絞り込みを行います。FMEA(故障モード影響解析)などが一般的によく用いられます。各工程のリスクを「発生頻度」「影響度」「検出難易度」でスコアリングし、リスクが高いと判断された工程やパラメータに重点を置いて検証計画を立てます。これにより、メリハリのある効率的なバリデーションが可能になります。
手順3:商業生産スケールでの検証シナリオの構築
リスク評価に基づき、実際の商業生産スケールでの検証シナリオを構築します。小規模スケールでは問題にならなかった課題(例:培養時間の延長による細胞へのストレス、充填時間の長さによる温度変化など)を考慮し、実製造と同じ条件下でのシミュレーションを行います。最悪条件(ワーストケース)を含めたチャレンジテストを組み込むかどうかも検討し、プロセスが持つロバスト性(堅牢性)を確認できるようなシナリオを作成します。
手順4:検証ロット数(3ロット等)の設定とその根拠の明記
一般的にプロセスバリデーションでは「3ロット」の繰り返し製造による検証が行われますが、再生医療等製品では検体の入手困難さなどから、必ずしも3ロットが適切とは限らない場合があります。しかし、統計的な信頼性を確保するためには、複数回の製造データが必要です。設定するロット数(3ロット、あるいはそれ以上・以下)については、その妥当性を統計学的根拠やガイドラインの解釈に基づいて計画書に明記します。「なぜこの回数で十分と言えるのか」を説明できるように準備しましょう。
手順5:計画書ドラフトの作成と品質部門による承認
全ての内容が固まったら、計画書のドラフトを作成します。作成されたドラフトは、製造部門だけでなく、品質保証(QA)、品質管理(QC)、場合によっては技術部門など、関係する全部署によるレビューを受けます。各専門分野の視点から不備や矛盾がないかを確認し、修正を加えます。最終的に品質保証責任者の承認を得て、計画書は正式発行されます。この承認プロセスを経て初めて、バリデーションの実作業に着手することが可能となります。
再生医療等製品特有の課題と計画策定時の留意点
再生医療等製品は、従来の低分子医薬品やバイオ医薬品とは異なる独自の課題を抱えています。そのため、一般的なバリデーションの手法をそのまま適用しようとすると、矛盾や実施困難な状況に陥ることがあります。ここでは、再生医療特有の事情を考慮した上で、計画策定時に特に留意すべき4つのポイントについて深掘りします。
原材料(細胞)の不均一性とばらつきを考慮した許容範囲設定
再生医療において最大の特徴は、原材料である細胞や組織の個体差による不均一性です。ドナーの年齢や健康状態によって細胞の増殖能や活性が異なるため、製造プロセスにはある程度の柔軟性が求められます。計画策定時には、このばらつきを前提とした許容範囲(管理幅)の設定が必要です。厳密すぎる一点の値を設定するのではなく、品質への影響がない範囲での幅を持たせた設定や、工程内での調整(フィードバック制御など)をどのようにバリデーションするかを明確にしておくことが重要です。
無菌操作プロセスにおける無菌性保証の計画
多くの再生医療等製品は最終滅菌ができないため、製造プロセス全体を通じた無菌性の保証が極めて重要になります。プロセスバリデーション計画には、無菌操作プロセスシミュレーション(メディアフィルテスト)の実施計画を適切に組み込む必要があります。培地を用いた模擬製造により、無菌操作の妥当性を証明します。実施頻度、介入操作の検証、作業者の適格性確認など、無菌性保証に関するガイドライン(無菌操作法による無菌医薬品の製造に関する指針など)に準拠した詳細な計画が求められます。
ベリフィケーションとバリデーションの使い分け
製造ロット数が極端に少ない場合や、患者ごとの自家細胞製品の場合、従来のプロセスバリデーション(3ロット検証など)が馴染まないことがあります。このようなケースでは、「ベリフィケーション(検証)」のアプローチが有効な場合があります。全数検査によって品質を保証できる項目や、連続的なモニタリングによって管理できる項目については、バリデーションではなくベリフィケーションとして整理することも検討しましょう。用語の定義と使い分けを計画書内で明確にし、品質保証のロジックを破綻させないことが肝要です。
コンカレントバリデーションの適用判断と正当性の説明
希少疾病用医薬品など、検体数が限られ、短期間での開発が求められる場合、商用生産と並行してバリデーションを行う「コンカレントバリデーション」が認められることがあります。しかし、これはあくまで例外的な措置です。適用するには、患者への供給を優先すべき緊急性や、プロスペクティブバリデーション(事前の検証)が困難な合理的な理由が必要です。計画書には、コンカレントを採用する正当性を詳細に記述し、得られたデータをどのように評価・承認して出荷可否を判断するか、厳格な手順を定めておく必要があります。
まとめ
プロセスバリデーション計画の策定は、再生医療等製品の品質保証における出発点であり、GCTP省令への適合を示すための最重要プロセスの一つです。科学的妥当性に基づいたCPPとCQAの設定、リスクマネジメントによる評価項目の絞り込み、そして再生医療特有の課題への柔軟な対応。これらを網羅した計画書を作成することで、規制当局への説得力を高め、スムーズな承認申請と商用生産への移行が可能になります。
また、バリデーションは一度実施して終わりではありません。計画書に基づいて得られたデータは、その後の継続的な工程確認(CPV: Continued Process Verification)へと活用され、製品ライフサイクル全体を通じた品質改善の基盤となります。本記事で解説した手法と視点を参考に、貴社の製品特性に合わせた、堅牢かつ実効性のあるプロセスバリデーション計画を策定してください。
プロセスバリデーション計画の策定手法についてよくある質問
プロセスバリデーション計画の策定において、実務担当者から頻繁に寄せられる質問とその回答をまとめました。計画書作成時の疑問解消にお役立てください。
-
バリデーションのロット数は必ず3ロット必要ですか?
- 伝統的に3ロットが目安とされていますが、必須ではありません。再生医療等製品では、検体入手の制約などにより3ロット未満となるケースもあります。重要なのは「3ロット」という数字ではなく、プロセスの一貫性と再現性を統計的に説明できる根拠があるかどうかです。科学的な正当性があれば、異なるロット設定も可能です。
-
開発段階のデータをバリデーションデータとして流用できますか?
- 商用生産と同一の設備、同一のプロセス条件、同一のスケールで製造されたデータであれば、流用できる可能性があります。しかし、スケールアップや設備変更があった場合は、改めてバリデーションを実施するか、同等性を証明するブリッジング試験が必要になります。
-
コンカレントバリデーションはどのような場合に認められますか?
- 希少疾病用製品や、製品の有効期間が極めて短く結果を待ってからの出荷が困難な場合などに限定的に認められます。適用には、患者へのメリットがリスクを上回るという明確な理由と、各ロットごとの厳格な品質評価体制が必要です。
-
計画書承認後に内容を変更する必要が出た場合はどうすればよいですか?
- 計画書自体の改訂を行うか、変更管理手順(Change Control)に従って変更申請書を作成し、品質保証部門の承認を得る必要があります。変更の理由と、それがバリデーションの結果や製品品質に与える影響を評価し、文書化することが不可欠です。
-
重要工程パラメータ(CPP)はどのように選定すればよいですか?
- 製品開発段階の知識(QbD)とリスクアセスメント(QRM)に基づいて選定します。各パラメータが重要品質特性(CQA)に与える影響度を評価し、影響が大きいものをCPPとして設定します。実験計画法(DoE)などのデータを根拠にすることが推奨されます。
<script type="application/ld+json">
{
"@context": "https://schema.org",
"@type": "FAQPage",
"mainEntity": [
{
"@type": "Question",
"name": "バリデーションのロット数は必ず3ロット必要ですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "伝統的に3ロットが目安とされていますが、必須ではありません。再生医療等製品では、検体入手の制約などにより3ロット未満となるケースもあります。重要なのは「3ロット」という数字ではなく、プロセスの一貫性と再現性を統計的に説明できる根拠があるかどうかです。科学的な正当性があれば、異なるロット設定も可能です。"
}
},
{
"@type": "Question",
"name": "開発段階のデータをバリデーションデータとして流用できますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "商用生産と同一の設備、同一のプロセス条件、同一のスケールで製造されたデータであれば、流用できる可能性があります。しかし、スケールアップや設備変更があった場合は、改めてバリデーションを実施するか、同等性を証明するブリッジング試験が必要になります。"
}
},
{
"@type": "Question",
"name": "コンカレントバリデーションはどのような場合に認められますか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "希少疾病用製品や、製品の有効期間が極めて短く結果を待ってからの出荷が困難な場合などに限定的に認められます。適用には、患者へのメリットがリスクを上回るという明確な理由と、各ロットごとの厳格な品質評価体制が必要です。"
}
},
{
"@type": "Question",
"name": "計画書承認後に内容を変更する必要が出た場合はどうすればよいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "計画書自体の改訂を行うか、変更管理手順(Change Control)に従って変更申請書を作成し、品質保証部門の承認を得る必要があります。変更の理由と、それがバリデーションの結果や製品品質に与える影響を評価し、文書化することが不可欠です。"
}
},
{
"@type": "Question",
"name": "重要工程パラメータ(CPP)はどのように選定すればよいですか?",
"acceptedAnswer": {
"@type": "Answer",
"text": "製品開発段階の知識(QbD)とリスクアセスメント(QRM)に基づいて選定します。各パラメータが重要品質特性(CQA)に与える影響度を評価し、影響が大きいものをCPPとして設定します。実験計画法(DoE)などのデータを根拠にすることが推奨されます。"
}
}
]
}
</script>